Die Aussaat von Freilandorchideen
- Teil 7 - Die Aussaat -
Orchideensamen sind sehr unterschiedlich in ihrem Aussehen, ihrer Keimfähigkeit und ihrem Verhalten während und nach der Aussaat. Falls man sie nicht kurz nach der Ernte aussäen kann, sollte man die Samen nach guter Trocknung in ein Papiertütchen abfüllen und in den Kühlschrank legen. Manche Samen, z.B. von Dactylorhiza oder Himantoglossum, behalten etliche Jahre ihre Keimfähigkeit, andere, z.B. Disa uniflora, keimen nur innerhalb weniger Wochen. Von vielen Arten ist die Lagerfähigkeit auch gar nicht bekannt. In der Literatur gibt es auch unterschiedliche Meinungen zum Einfrieren. Ich lagere die Samen im Kühlschrank.
Und dann gibt es Arten, die keimen ohnehin schlecht. Dazu zählen leider die meisten Cypripedien-Arten. Während Cyp. reginae oder guttatum noch relativ gut zum Keimen zu bringen sind, ist Cyp. calceolus eine harte Nuss, reife Samen davon keimen nur sporadisch und nur mit ziemlichem Aufwand an Hormonen im Nährmedium.
Zum Glück gibt es eine Methode, auch solche harten Nüsse zu knacken – die Grünaussaat. Dabei geht man von der Tatsache aus, dass viele Pflanzenembryonen schon keimfähig sind, ehe die volle Reife eingetreten ist. Im Gegenteil, erst durch die Samenreife werden offenbar Keimhemmstoffe oder andere Eigenschaften erzeugt, die dann die Keimung hemmen oder sogar ganz verhindern.
Es bleibt aber das Problem, dass der Zeitpunkt der "Ernte" ganz wichtig ist. Zu früh geerntet, und die Embryonen sind noch nicht ausreichend entwickelt, zu späte Ernte, und die Keimung funktioniert nicht mehr. Hat man mehrere Samenkapseln, dann kann man zu unterschiedlichem Zeitpunkt ernten und aussäen. So ungefähr 6-8 Wochen nach der Bestäubung kann man eine gute Keimung erwarten. Die Samen sollten noch nicht "flugfähig" sein sondern noch an den Samenleisten einigermaßen fest sitzen. Allerdings sind noch grüne oder grün-weiße Samenleisten fast immer ungeeignet, es gibt allerdings wenige Ausnahmen, bei denen auch völlig unreife Embryonen schon keimfähig waren. (Anmerkung Admin: weitere Infos zur Grünaussaat)
Aber zunächst zur Aussaat reifer Samen. Die Samen müssen zunächst desinfiziert werden, damit keine einzige Bakterie oder Schimmelspore in das Aussaatgefäß gelangt, da sonst der zuckerhaltige Nährboden diesen Keimen zur Nahrung dient und nicht den Embryonen, sie sich explosionsartig vermehren und alles überwuchern.
Was benötigt man zur Aussaat?
- einen Mikrospatel mit Schaufel
- einen normalen Mikrospatel
- ein Röhrchen zum Bleichen mit Deckel
Leider sind die hier abgebildeten Röhrchen, die ich seinerzeit bei Fa. Neolab kaufte, im Handel offenbar nicht mehr erhältlich, man muss sich anderweitig umschauen. Leider sind die auch die Verpackungseinheiten meistens sehr groß.

Dann braucht man natürlich geeigneten Nährboden als Schrägagar im Reagenzglas oder kleinerem Rundglas mit Deckel. Zum Dosieren und Absaugen der Bleichlösung dient eine sterile 5 – 10 ml-Spritze.
Ich beschreibe hier die Aussaat in ein Reagenzglas.
Wenn man einen größeren Vorrat an Samen hat, dann ist die optimale Menge in etwa eine leicht gehäufte Spatelspitze eines Mikrospatels, z.B. eine gut gefüllte Schaufel.

Die Samen füllt man in ein kleines verschließbares Röhrchen von max. 5 ml Volumen. Hier habe ich Samen von Gymnadenia conopsea als Beispiel gewählt.

Hinzu gibt man etwa 3-4 ml einer Lösung von 0,5% Natriumhypochlorit (NaOCl), hergestellt z.B. durch Verdünnen von handelsüblicher DanKlorix-Lösung. Diese Lösung hat einen Gehalt von 2,8% NaOCl. Man nennt diese Lösung auch „Bleichlösung“, weil dunkle Samen bei der Behandlung heller werden. Tatsächlich ist NaOCl ein klassisches Bleichmittel im Haushalt, z.B. auch für Wäsche.
Wenn man z.B. 50 ml Bleichlösung benötigt, so misst man 9 ml DanKlorix-Lösung ab und gibt 41 ml destilliertes Wasser dazu, die Lösung hat dann einen Gehalt von 0,5% NaOCl.
Das Verhältnis von Samenmenge und Bleichlösungs-Volumen ist nicht unkritisch. Zu wenig Bleichmittel für viele Samen kann dazu führen, dass die Keimhemmung nicht beseitigt wird. Bei dem genannten Verhältnis von 3-4 ml Bleichlösung auf eine Spatelschaufel eines Mikrospatels wird man aber keine Probleme bekommen.
Die Bleichlösung füllt man dann mit einer Spritze in das Röhrchen, verschließt es mit dem Deckel, stellt einen Kurzzeitwecker auf eine geeignete Zeit und beginnt das Röhrchen zu schütteln.

Nun etwas Theorie: Die bleichende und desinfizierende Wirkung des NaOCl auf die Samen besteht darin, dass die Chemikalie im Kontakt mit organischen Stoffen zerfällt und dabei elektronisch angeregten Sauerstoff entwickelt. Die Energie dieses Sauerstoffs wird dann auf die organischen Stoffe übertragen, wobei dies zur Abtötung der Keime führt. Außerdem wird die Samenhülle chemisch so behandelt, dass Keimhemmstoffe zerstört oder die Hülle durchlässiger für Wasser wird. Es ist nach wie vor etwas umstritten, worauf die Keimhemmung beruht. Gleichzeitig hellt sich die Samentesta durch den Bleichvorgang auf.
Weshalb muss man während des Bleichvorgangs das Röhrchen schütteln? Der durch den Bleichprozess sich entwickelnde Sauerstoff besteht zunächst aus unsichtbaren winzigen Bläschen, die sich aber allmählich zu größeren Blasen vereinigen. Man kann diese Blasen sehen, wenn man so ein Röhrchen eine Zeitlang nicht schüttelt, am besten unter einem Stereomikroskop. Die Blasen decken aber Teile der Samenoberfläche ab, so dass Bleichmittel nicht an alle Teile des Samens heran kommen kann. Es ist klar, dass dann keine vollständige Desinfektion der Samen erreicht wird.
Entscheidend für den Erfolg der Aussaat ist die richtige Verweilzeit der Samen in der Bleichlösung. Hypochlorite sind äußerst aggressive Chemikalien, die man auch nicht auf die Haut oder die Kleidung bringen sollte. Es ist ja klar, wenn die Bleichlösung durch die Samenhülle hindurch eindringt, beginnt die Schädigung des Embryos, und bei zu langer Bleiche sind die Embryonen tot. Bleicht man dagegen zu kurz, werden entweder nicht alle Keime abgetötet, oder die Keimhemmung wird nicht vollständig aufgehoben, man erhält dann schlechte oder gar keine Keimung.
Ich will hier einmal ein paar ungefähre Bleichzeiten nennen, wobei die eigene längere Erfahrung wichtig ist.
- Ophrys und die meisten Epiphyten ca. 5 – 7 min.
- Dactylorhiza ca. 7 – 10 min.
- Orchis, Himantoglossum ca. 8 – 15 min.
- Cypripedien 15 – 60 min, zum Teil 2 Stunden.
Hat man überhaupt keine Vorstellung, wie lange gebleicht werden muss, dann macht man eine sog. Bleichreihe, d.h. man bleicht z.B. 5 min. und 8 min. und 11 min. und beobachtet dann die Keimrate.
Nach der Bleiche haben sich die meisten Samen aufgehellt, nur bei ohnehin schon sehr hellen Samen wird man keine Wirkung feststellen können, hier muss nach Zeit gebleicht werden.
Sehr schön ist auch der Blick durch ein Stereomikroskop in das Bleichröhrchen, man kann dann sehr gut unterscheiden, ob nur die Testa heller geworden ist oder auch schon der Embryo.
Der Bleichlösung füge ich kein Netzmittel (Spülmittel) zu; denn sonst dispergieren die Samen in der Bleichlösung, d.h. sie verteilen sich gleichmäßig und sinken weder ab, noch steigen sie an die Oberfläche. Es ist klar, dass dann die Abtrennung der Samen von der Bleichlösung extrem erschwert ist. Und natürlich muss man am Ende der Bleiche die Samen wieder von der Bleichlösung trennen.
Amerikanische Orchideenfreunde geben Netzmittel zur Bleiche dazu und legen mittels Handpumpe oder Wasserstrahlpumpe Unterdruck an. Dann sinken die Samen am Ende der Bleiche zu Boden und können so auch abgetrennt werden. Meine Versuche in dieser Richtung führten manchmal dazu, dass die Samen beim Anlegen des Unterdrucks in der Absaugvorrichtung verschwanden, bei seltenen Arten (Cyp. arietinum) ist dies sehr ärgerlich, deshalb habe ich dieses Verfahren nicht mehr betrieben.
Normalerweise steigen die Samen am Ende der Bleiche wieder an die Oberfläche, wenn man das Röhrchen für ein paar Sekunden ruhig stellt. Oft hat sich die Bleichlösung auch verfärbt, das hängt von Gattung und Art ab, in diesem Beispiel also Verfärbung nach gelb.

Mit einer Spritze, deren Kanüle bis auf den Boden des Röhrchens reicht, saugt man dann die Bleichlösung ab.

In vielen Fällen ist es dann sinnvoll, die Samen noch ein- oder mehrmals mit sterilem dest. Wasser zu waschen. Dazu füllt man wiederum 3 – 4 ml Wasser ein und schüttelt ca. 20 Sekunden gut durch. Danach wird wieder abgesaugt. In vielen Fällen ist diese Wäsche aber gar nicht notwendig, weil der Nährboden die winzige Menge an mit den Samen eingeschlepptem Bleichmittel rasch neutralisiert. Ich wende diese Wäsche nur bei seltenen Arten an, deren Verhalten ich noch nicht kenne.
Samen von Epiphyten, z.B. Dendrobien, aber auch sehr feine Samen von Erdorchideen, z.B. Calypso, neigen zum Dispergieren. Die Abtrennung des Bleichmittels kann dann extrem schwierig sein oder zu lange dauern, so dass die Bleichzeit viel zu lang wird und die Embronen dadurch abgetötet werden. Wenn man das während der Bleiche beobachtet, hat man zwei Möglichkeiten, doch noch zum Erfolg zu kommen.
Zum einen kann man ein winziges Stück Toilettenpapier (eine Lage) gegen Ende der Bleiche mit in das Bleichröhrchen stecken und zum Schluss das Bleichmittel mit dem Oval einer Spritze durch das Papier filtriert absaugen. Das geht nach etwas Übung meistens ganz gut, und das winzige Stück Papier wird dabei auch noch ausreichend desinfiziert.
Eine andere Möglichkeit besteht darin, dass man eine besonders feine Kanüle für die Spritze benutzt. Die Durchmesser und Länge der Kanülen sind durch Farben gekennzeichnet:
| rot | 1,5 mm Ø | 30 mm lang, zum Dosieren von Nährboden in Reagenzgläser |
| gelb | 0,9 mm Ø | 37 mm, zum Absaugen von Bleichlösung bei großen Samen |
| blau | 0,6 mm Ø | 30 mm, zum Absaugen von Bleichlösung bei mittleren Samen |
| rosa | 0,4 mm Ø | 23 mm, bei sehr feinen und dispergierten Samen |
Insbesondere bei den sehr feinen und dispergierten Samen von Epiphyten und auch Calypso hat sich die rosa Kanüle bewährt. Beim Absaugen stauen sich die Samen vor dem zu engen Einlass, man muss diese dann mehrfach abschütteln ehe man weiter absaugt. Die Kanüle ist zwar mit 23 mm Länge zu kurz, um bis auf den Boden des Röhrchens zu reichen, aber durch geschicktes Kippen des Röhrchens kann man die Bleichlösung relativ gut absaugen.
Mit einer weiteren Alternative, einer Fritte zum Desinfizieren und Absaugen, habe ich keine Erfahrung.
Wenn dann nach einmaligem Absaugen oder mehrmaligen mit Zwischenwäsche die Samen im Röhrchen i.w. frei von Flüssigkeit sind, kann man sie mit einem Mikrospatel an der Wand des Röhrchens zu einem Häufchen zusammenkratzen. Dabei stellt man fest, dass doch noch Flüssigkeit enthalten ist, die man noch entfernen muss, damit man die Samen gut mit dem Spatel aufnehmen kann.

Dazu hält man das Röhrchen schräg mit der Öffnung nach unten und saugt mit der Spritze nochmals durch das Häufchen hindurch die Flüssigkeit ab. Dabei verfestigt sich das Häufchen, so dass man es bequem in mehrere Teile aufteilen kann, hier z.B. in 6 Teile.
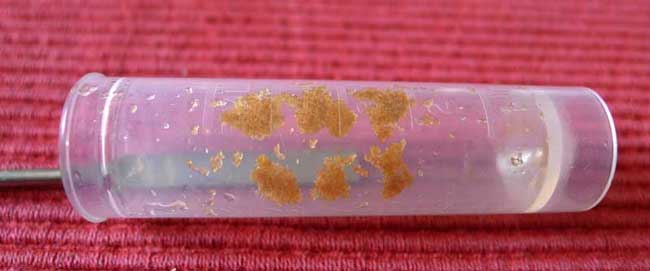
Dieses Aufteilen wird man dann machen, wenn man auf mehrere Nährbodentypen aussäen oder auch nur in mehrere Gläser zur Verminderung des Verkeimungsrisikos aussäen will. Ich verwende bei mir noch unbekannten Arten meistens 3 verschiedene Böden, auf die ich jeweils 2 x aussäe, so dass ich 6 Häufchen brauche. Hat man nur sehr geringe Samenmengen, dann ist es im Extremfall eben nur ein einziges Glas. Wegen der Infektionsgefahr und dem Keimverhalten auf unterschiedlichen Böden sollte man aber anstreben, in mehrere Gläser auszusäen.
Die Samen der einzelnen Häufchen hole ich mit dem Mikrospatel aus dem Bleichröhrchen heraus. Die restliche Feuchte der Samen sorgt dafür, dass sie als Klumpen am Mikrospatel haften und so auch in die Gläser transferiert werden können.
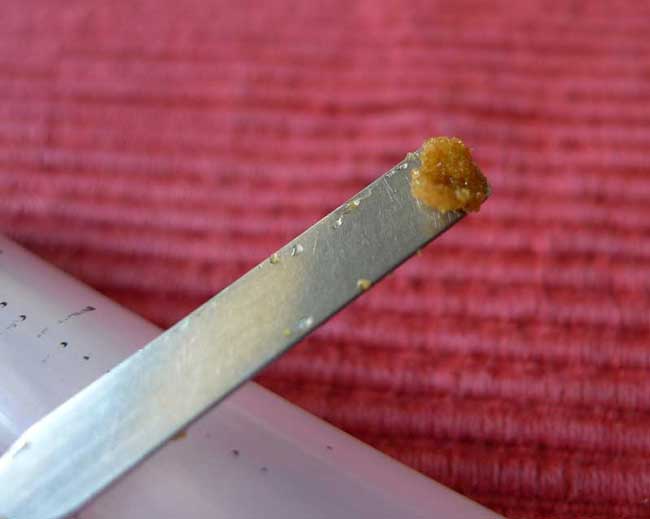
Ausgesät wird entweder in Reagenzgläser mit Schrägagar oder kleinere Rundgläser oder auch in Petrischalen. Das vorbereitete Reagenzglas wird geöffnet und bereit gehalten.

Ich benutze nur Reagenzgläser und kleine Rundgläser. Bei Aussaat in Reagenzgläser ist darauf zu achten, dass man keine Samen in den oberen Teil des Röhrchens bringt, sondern alles auf der schrägen Agarfläche ablädt. Dazu hält man das Reagenzglas mit einer Hand, mit der anderen Hand hält man den Spatel beim Einführen so, dass er am oberen Glasrand abgestützt sicher ohne Kontakt der Samen mit der Glaswand bis zur Agarfläche gebracht wird.

Dort streicht man den Samen ab und verteilt ihn auf der Fläche.

Verwendet man Rundgläser, ist das Verteilen mit dem Spatel nicht so einfach, weil er praktisch senkrecht steht. Aber mit dem eingangs gezeigten Mikrospatel mit einer kleinen Schaufel an einem Ende lassen sich die Samen auf der Oberfläche gut verteilen.
Schließlich werden die Aussaatgefäße verschlossen, die Reagenzgläser mit dem sterilen Wattestopfen, ich verwende als Nächstes ein Stück sterile Alufolie, die ich in größerer Stückzahl in einem Marmeladenglas im Drucktopf sterilisiert habe. Rundgläser werden mit dem Deckel mit Wattestäbchen verschlossen, dann wird in beiden Fällen Frischhaltefolie übergezogen und mit einem Gummiring gesichert. Die Gläser werden bei Erdorchideen im Dunkeln aufgestellt, bei Lichtkeimern wie den meisten Epiphyten hell – natürlich nicht in vollem Sonnenlicht.
Bei der Grünaussaat geht man prinzipiell ähnlich vor, nur kann man davon ausgehen, dass die noch unreifen Samen in der Kapsel steril sind und nicht desinfiziert werden müssen. Allerdings muss man sich die Kapsel genau anschauen. Könnte sie sich schon einmal leicht geöffnet haben? Dann ist der Inhalt nicht mehr steril und der Aufwand sinnlos. Haben Insekten oder Raupen schon einmal daran genascht? Dann ist der Inhalt ebenfall nicht mehr steril. Ich habe schon winzige Räupchen in Kapseln gefunden. Gibt es in der Kapsel ein Loch? Na ja, meistens sind die Kapseln in Ordnung. Blüten- und Stängelreste werden mit einer Nagelschere sorgfältig abgeschnitten, wobei man die Kapsel möglichst nicht quetscht, da sie sich sonst leicht öffnet – schließlich ist sie kurz vor der Reife.
Wie kommt man steril an den Inhalt? Die Kapsel außen ist ja mit Keimen kontaminiert, man muss sie also desinfizieren. Dazu verwendet man ebenfalls DanKlorix-Lösung, nun aber in voller Konzentration und in diesem Fall auch mit Zugabe von etwas Spülmittel. Da die Desinfektionslösung in diesem Fall nicht mit den Samen in Innern in Berührung kommt, spielt die Zeit der Desinfektion keine Rolle – ich wähle meistens 10 Minuten. Bei sehr kleinen und dünnwandigen Kapseln kann diese Zeitspanne auch schon zu lang sein, dann muss man auf 5 Minuten reduzieren, damit keine Bleichlösung in die Kapsel gerät.
In Rissen der Kapseloberfläche oder den Blütenresten finden sich am ehesten noch Keime, so dass auch hier während der Desinfektion auf ständige Bewegung in der Lösung zu achten ist.
Nach der Desinfektion werden Stielende und Blütenende mit einem sterilen Skalpell abgeschnitten, da dort die Gefahr von noch versteckten Keimen am größten ist. Dann wird die Kapsel mit dem Skalpell längs durchgeschnitten und der Inhalt mit einem Mikrospatel ausgekratzt.
Es werden immer kleine Anteile der Samen mit dem Spatel in das Aussaatgefäß gebracht, bis alles verbraucht ist.
Die Aussaatgläser werden nach 2 und 4 Tagen kontrolliert. Schimmel zeigt sich sehr schnell, Bakterien zeigen sich erst später, zum Teil erst nach mehr als 10 Tagen. Im Falle von Infektionen lohnt eine Rettung grundsätzlich nicht, in fast allen Fällen verkeimten dann auch die Gläser, in welche die Samen zur Rettung übertragen wurden. Aber man vermeidet mit dieser Kontrolle eine Übertragung von Glas zu Glas.
© Text und Bilder: Dr. Claus Rüdiger Bernert - @
